最近发现,血管内皮细胞分泌的一种蛋白质具有对肝脏损伤后的细胞增殖修复功能进行时相调节的作用。该研究成果进一步证实血管信号(vascular signal)对所在组织的再生增殖功能也具有调控作用。文献阅读:Nature 2014 Feb 19;506(7488):299-300.
众所周知,肝脏的再生修复能力是非常惊人的,这一切都得益于一系列生物因子之间密切、及时,并非常精准的配合,让肝脏的代谢及合成功能能够迅速恢复。在科研工作中,最常用到的肝脏损伤模型就是被手术切除部分肝脏的动物模型,因为在这种情况下不会发生炎症反应或者坏死等情况,能够避免这些其它因素的干扰,方便科研人员们研究肝脏的再生过程。这种接受了肝部分切除术的脊椎动物的肝脏通常在5至7天的时间内就能够得到恢复,而这段时间似乎也是动物的肝脏功能得以恢复,以确保动物能够继续生存下去的关键期。
但是科学家们一直不清楚动物的肝脏是如何感知损伤信号,是如何启动再生修复机制,又是在什么时候决定,并且如何终止修复的。大约在40多年前,有人提出了肝脏血液循环系统在肝脏再生修复过程中也起到了一定作用的观点。Hu等人最近在《科学》(Science)杂志上发表了一篇文章,他们发现血管生长因子(angiocrine factor)这种由血管内皮细胞分泌的信号分子也参与了肝脏再生修复的时相调控工作,为40多年前提出的那种理论提供了新的证据。
科学家们经过多年研究,基本已经清楚动物的肝脏被部分切除之后会发生哪些事件,历经哪些过程,这基本上可以被分为两大阶段:第一个阶段是诱导期(inductive phase),这个过程大约持续1至3天,在此阶段肝细胞会大量再生、增殖,肝细胞数量迅速增加;第二个阶段是血管生成期(angiogenic phase),在这个阶段主要形成新生血管,以及其它肝脏组织内的非肝脏细胞,包括各种支持细胞、间质细胞等,促进肝脏组织的再生和修复。
Hu等人对小鼠肝血窦内皮细胞(liver sinusoidal endothelial cell, LSEC)进行了转录组学研究,发现血管生成素2(angiopoietin 2, Ang2)这种促进血管生成的细胞因子的表达水平在肝脏再生过程中发生了动态的变化(图1)。在诱导期中,Ang2的表达水平是下调的,致使转化生长因子β(transforming growth factorβ)等抑制细胞增殖的分子表达量也跟着下调,而加速肝细胞再生的细胞周期蛋白D1(cyclin D1)等分子的表达量则迅速上调。到了血管生成期时,Ang2的表达水平恢复到了基础水平,刺激LSEC细胞以依赖血管内皮生长因子2(vascular endothelial growth factor receptor 2, VEGFR2)和Wnt2蛋白的方式进行增殖。
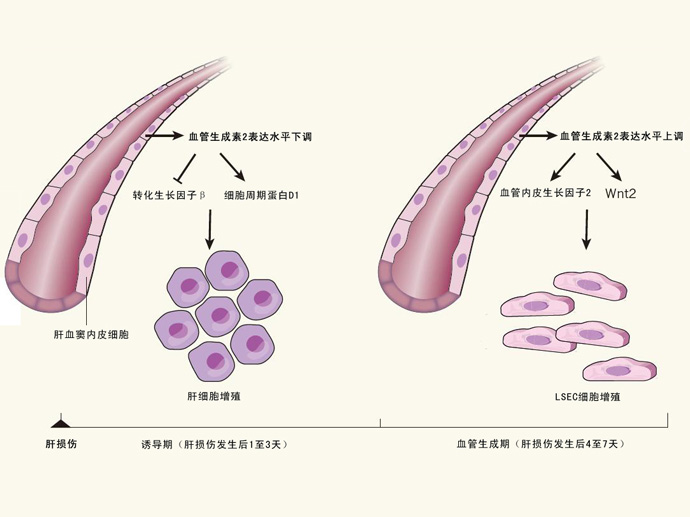
图1.肝脏损伤之后Ang2蛋白表达水平的动态变化过程。Hu等人发现,在肝脏损伤之后,LSEC细胞分泌的Ang2蛋白的表达水平呈现出一种动态变化的过程,这种动态变化与肝脏损伤之后的诱导期和血管生成期相互配合,促进了肝脏的修复。在诱导期时,Ang2蛋白的表达水平下调,促使TGF-β等因子的表达被抑制,而细胞周期蛋白D1等分子的表达反而增多,促使肝细胞增殖。到了血管生成期时,Ang2蛋白表达量上升,促进VEGFR2和Wnt2等蛋白的表达,促进LSEC细胞的增殖。
Hu等人还发现,在肝脏接触了有毒的四氯化碳(carbon tetrachloride)之后,Ang2蛋白也参与了慢性化学肝损伤之后的生理反应。看起来LSEC细胞好像是先人后己般雷锋式的好细胞,最开始先突进肝细胞的增殖,然后才想到自己,促进血管生长。有意思的是,有一篇文章介绍了这样一项工作,有科研人员对急性肝功能衰竭患者肝脏内Ang2蛋白的表达水平进行了检测,结果发现Ang2蛋白的表达水平越高,患者的预后越差,这进一步证实Ang2信号因子与临床及治疗之间的关系非常密切,也证实该蛋白的确是由血管内皮细胞分泌的。
之前开展的一项研究已经证实LSEC细胞与VEGFR2因子对于肝脏修复具有非常重要的作用和意义,该研究对Id1蛋白、Wnt2蛋白以及能够促进肝细胞增生的肝细胞生长因子(hepatocyte growth factor, HGF)等蛋白的表达水平进行了检测。不过在那项研究里发现,VEGFR2因子似乎在诱导期起到了主要的作用。该课题组还发现,在肝脏遭受急性损伤,或经历长期炎症之后的疤痕期阶段,这些促血管生成的信号因子(angiocrine signalling)也都参与了对组织修复的调控工作,该作用主要依靠的是表达LSEC细胞上的受体蛋白CXCR7,该蛋白能够在肝脏急性损伤之后负责调控促再生的Id1–Wnt2/HGF反应。在发生慢性炎症时,CXCR7蛋白的表达会受到抑制,致使修复工作出现障碍,导致疤痕形成。
用Ang2蛋白和VEGFR2蛋白特异性失活的细胞进行更进一步的研究将帮助我们更清楚地揭示在肝脏修复过程中的诱导期和血管生成期等阶段,这些因子之间有着怎样复杂的相互作用。不过Hu等人的工作已经非常清楚地表明,在整个肝脏修复过程中,Ang2蛋白的表达水平对肝细胞的增殖和LSEC细胞的增殖已经起到了非常明显的调控作用。Ang2蛋白的血管生成作用与之前报道的,发生应激反应时该蛋白对血管的保护作用相吻合。内皮组织(endothelium)分泌的其他促血管生成因子,比如前列腺素E2(prostaglandin E2)、环氧-二十碳三烯酸(epoxyeicosatrienoic acids)和氧化亚氮(nitric oxide)等也对肝脏的再生具有一定的促进作用。内皮细胞及其分泌的这些因子也参与了肺脏、造血干细胞和肾脏组织的再生过程当中。
肝脏对器官损伤能够迅速做出反应。但是肝脏内的血管内皮细胞也能够对损伤做出如此快速、如此协调的反应吗?看起来好像是这样。在肝脏被部分切除之后,剩余的肝脏组织还都是完好无损的,它们并没有接触到毒物或者坏死的肝细胞。可是肝脏内的血管却不一样,因为缺少了部分肝脏,所以相应地也缺少了部分的脉管系统,剩余的肝内脉管系统立即就能感受到血流的变化情况,同样也有可能会感受到脉管系统内可溶性信号分子含量的变动情况。由于肝脏被部分切除之后体积变小,而肝脏的血供并没有相应的减少,所以血流动力学参数及其中含有的可溶性因子的含量肯定会发生变化,这可能就是在肝脏损伤之后LSEC细胞在第一时间里感受到的信号。同样的,在肝脏发生化学毒性损伤之后,肝细胞往往会肿大或者死亡,这也会改变肝内的血流动力学参数。因此,肝内的血管内皮细胞既能够感受到肝脏的完整性和体积大小的变化,也能够感受到肝脏代谢能力的变化,并且根据这些变化迅速的做出相应的反应。
有人可能还会想到,内皮细胞是否也会直接促进肝内其它非肝细胞的生长,比如促进胆管内皮细胞(biliary epithelial cell)或星状细胞(stellate cell)的生长。而且还能够在修复工作完成之后立即停止细胞的进一步增殖。可是一个分子能够胜任这么繁重的工作吗?可能不行,因为在肝脏发生损伤之后,肝细胞能够进行最佳的修复就是维持整个生命体生命的关键,我们已经知道在这整个过程当中,有多种因子在相互配合着完成这项修复工作。可是Hu等人的工作表明,肝脏血管内皮细胞分泌的信号因子的表达水平在整个修复过程中也在发生动态的变化,并且对整个修复过程进行着调控。从中我们能够体会到什么呢?要想办法促进肝脏患者的肝细胞快速再生,我们就要竭尽所能地放开各种阻止肝细胞再生的刹车,而且还要尽可能的踩下油门。
