决定肝癌是否行射频消融的最重要因素是生物学特性,而非癌肿大小
首都医科大学附属北京朝阳医院西区肝胆胰腺外科 孙文兵
众所周知,射频消融(RFA)治疗肝细胞癌(HCC)的原理是用热能毁损癌组织,治疗方式是“一口一口地吃”。这就决定了RFA治疗HCC,常常不像肝移植“一窝端”那么彻底,也不像肝切除“一切了之”那么干脆。
从某种程度上讲,癌组织残留发生率较高是RFA治疗HCC的“短板”。为了最大程度地预防癌灶残留,人们通常将HCC选择RFA治疗的适应证限定在直径≤5 cm,认为较大体积的HCC不适合RFA治疗。
自2006年5月起,我们在开展RFA治疗HCC 6年经验的基础上,开始尝试对失去手术机会的大肝癌行RFA治疗,部分病例取得了满意的疗效,引发了我们一些思考。
典型病例
患者,男性,49岁,河北籍,发现慢性乙型肝炎5年。2007年1月,因右上腹胀痛不适1周、CT提示“右肝巨块型癌,8.5 cm×7.5 cm×6.6 cm”(图1)来我院就诊。考虑到右肝癌体积大,且有肝硬化门静脉高压症背景,若采取手术切除,需要切除近乎50%的肝脏,术后发生感染、出血、肝功能不全等严重并发症的可能性大,风险高,故制定了RFA联合经导管肝动脉化疗栓塞(TACE)的局部治疗方案。具体如下述。
第一步:先行TACE
2007年3月27日,行血管造影和介入栓塞治疗。血管造影显示“右肝癌体积大,且血供丰富(图2)”。TACE达到了三方面的目的:①进一步明确HCC病灶的范围,排除了超声、CT遗漏病灶的可能性;②减少了癌灶内的血液供应,以期提高RFA效率;③对HCC行局部化疗,并以期提高HCC对RFA治疗的敏感性。2007年4月17日复查CT,显示癌灶内碘剂栓塞效果良好(图3)。
第二步:CT定位下RFA
2007年4月23日,在CT定位下行经皮肤RFA。2007年4月28日,增强CT显示“癌灶己得到大部分消融,但周边仍有可疑残留组织(图4)”。为了更彻底地清除癌灶,于2007年4月30日再次在CT定位下行经皮RFA。
第三步:随访观察
大范围的射频消融,容易产生局部组织坏死、液化,进而可继发感染,需随访观察。第二次RFA后8天,复查CT,见癌灶坏死较为完全(图5)。继之,患者每日下午出现发热,体温通常波动于38℃~39℃,不伴有寒战。再次复查CT,见射频消融区有一定程度的缩小,内有气体积聚,提示有感染(图6)。
第四步:射频消融液化灶穿刺置管引流术
2007年6月1日,在超声定位下行射频消融液化灶穿刺置管引流术,抽出黏稠性液体240 ml,置管后每日冲洗(图7),后逐渐缩小(图8)。2个月后,复查CT,见液化腔消失,拔出引流管后,再行增强CT,见病灶区只留下一炎性小灶,未见癌组织残留(图9)。
第五步:随访
术后一年复查增强CT,无癌灶残留或再发征象。
思考
上述病例的病灶之大是少见的,所取得的疗效也是令人满意的。更令人欣喜的是,类似的成功病例并不少见。
传统理论认为,在HCC发展过程中,侵袭性强、转移潜能高的细胞由少变多,导致肿瘤增大,恶性程度增高。这一传统的思维定式导致了人们长期以来依据肿瘤大小来决策治疗和预测预后。近年来,人们越来越多的认识到,HCC的预后并不完全与大小相关,一些体积虽小,却已发生肝内转移,预后差;而一些即使体积大,也不伴有浸润转移现象,预后好。仅用直径≤5 cm作为RFA的适应证,缺乏合理性,势必产生两方面的问题:①一部分本可以用RFA取得满意疗效的大肝癌被拒之门外;②虽然直径≤5 cm,但由于侵袭转移能力强,并不适宜RFA治疗的HCC,也加入了RFA治疗的行列,错失了最佳治疗方案。基础研究也显示,HCC的侵袭性在原发瘤阶段即已定型,在发展的过程中,并不发生明显的侵袭转移能力方面的改变。上述研究进展导致了对应用HCC大小决策治疗和预测预后的质疑。
作为HCC生物学特性的核心,侵袭转移能力才是影响RFA治疗效果的最重要因素。侵袭转移能力强,早期发生微静脉浸润转移的可能性大,即便是癌灶小,也易发生残留,不适合局部治疗;反之,侵袭转移能力弱,在HCC的生长过程中,不易发生微静脉浸润转移,即便是癌灶较大,也适合局部治疗。
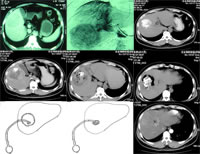
图1 CT显示右肝巨大肝癌
图2 血管造影,显示右肝癌体积大,且血供丰富
图3 TACE后复查CT,显示癌灶内填充的碘剂将肝癌的轮廓显示得较为清晰
图4 第一次射频消融治疗后,见癌灶己得到大部分消融,但周边仍有可疑残留组织
图5 第二次射频消融治疗后8天,复查CT,见癌灶坏死较为完全
图6 第二次射频消融治疗后22天,复查CT,见射频消融区呈缩小和液化趋势
图7 液化灶内置管引流
图8 液化灶明显缩小
图9 射频消融区液化灶穿刺置管引流术后2个月复查CT,见液化腔消失,未见癌组织残留
责任编辑 张彦
